PRP מודרני: "PRP קליני"
בעשר השנים האחרונות תוכנית הטיפול של PRP עברה שינויים גדולים.באמצעות מחקר ניסיוני וקליני, יש לנו כעת הבנה טובה יותר של הפיזיולוגיה של טסיות דם ותאים אחרים.בנוסף, מספר הערכות שיטתיות באיכות גבוהה, מטה-אנליזות ומחקרים מבוקרים אקראיים הראו את היעילות של ביוטכנולוגיה של PRP בתחומים רפואיים רבים, כולל דרמטולוגיה, ניתוח לב, ניתוחים פלסטיים, ניתוחים אורתופדיים, ניהול כאבים, מחלות עמוד השדרה ורפואת ספורט .
המאפיין הנוכחי של PRP הוא ריכוז הטסיות המוחלט שלו, שמשתנה מההגדרה הראשונית של PRP (כולל ריכוז טסיות הדם הגבוה מערך הבסיס) ליותר מ- 1 × 10 6/μ L או פי 5 מריכוז הטסיות המינימלי בטסיות דם מן קו בסיס.בסקירה הנרחבת של Fadadu et al.33 מערכות PRP ופרוטוקולים הוערכו.ספירת הטסיות של תכשיר ה- PRP הסופי המיוצר על ידי חלק מהמערכות הללו נמוכה מזו של הדם המלא.הם דיווחו כי גורם הטסיות של PRP גדל עד 0.52 עם ערכת הספין היחידה (Selphyl ®).לעומת זאת, ריצוף כפול genesis genesis pureprpii ® ריכוז הטסיות המיוצר על ידי המכשיר הוא הגבוה ביותר (1.6 × 10 6 /μl).
ברור ששיטות חוץ גופיות ובעלי חיים אינן סביבת המחקר האידיאלית להפיכת מוצלחת לתרגול קליני.באופן דומה, מחקר השוואת המכשירים אינו תומך בהחלטה, מכיוון שהם מראים כי ריכוז הטסיות בין מכשירי PRP שונה מאוד.למרבה המזל, באמצעות טכנולוגיה וניתוח מבוסס פרוטאומיקה, אנו יכולים להגביר את ההבנה שלנו את פונקציות התא ב- PRP המשפיעות על תוצאות הטיפול.לפני שתגיע לקונצנזוס על תכשירים וניסוחים סטנדרטיים של PRP, PRP צריך לעקוב אחר ניסוחים PRP קליניים כדי לקדם מנגנונים לתיקון רקמות משמעותיים ותוצאות קליניות מתקדמות.
נוסחת PRP קלינית
נכון לעכשיו, PRP קליני אפקטיבי (C-PRP) התאפיין כהרכב מורכב של רכיבים רב-תאיים אוטולוגיים בפלזמה בנפח קטן המתקבל מחלק מהדם ההיקפי לאחר צנטריפוגה.לאחר הצנטריפוגה, ניתן לשחזר PRP ורכיבי התאים הלא-טסוניים שלו ממכשיר הריכוז בהתאם לצפיפות תאים שונים (מהם צפיפות הטסיות היא הנמוכה ביותר).
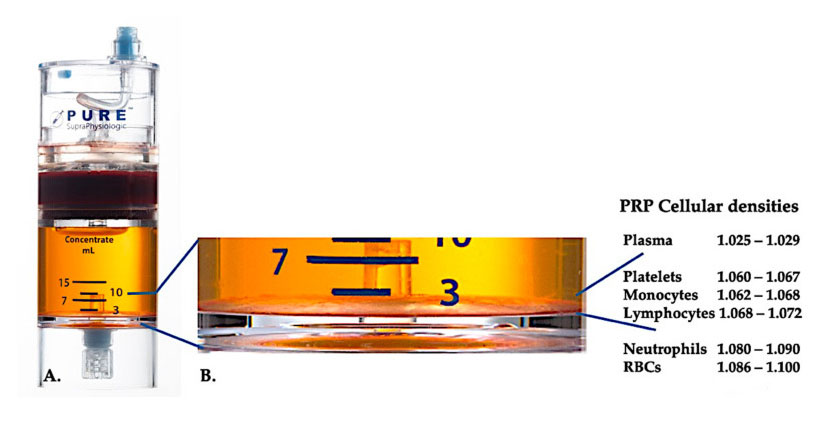
השתמש בציוד ההפרדה של צפיפות תאים של Purepreprp-SP ® (Emcyte Corporation, Fort Myers, FL, USA) שימש לדם מלא לאחר שני נהלי צנטריפוגה.לאחר תהליך הצנטריפוגה הראשון, רכיב הדם המלא הופרד לשתי שכבות בסיסיות, מתלה טסיות (רזה) פלזמה ושכבת תאי דם אדומים.ב- A הושלם שלב הצנטריפוגה השני.ניתן לחלץ את נפח ה- PRP בפועל ליישום המטופל.ההגדלה ב- B מראה כי קיימת שכבה חומה משקעי אריתרוציטים מרובי-רכיבים מאורגנים (המיוצגים על ידי קו כחול) בתחתית הציוד, המכילה ריכוזים גבוהים של טסיות דם, מונוציטים ולימפוציטים, המבוססים על שיפוע הצפיפות.בדוגמה זו, על פי פרוטוקול ההכנה C-PRP עם נויטרופילים עניים, יוצאו אחוז המינימום של נויטרופילים (<0.3%) ואריתרוציטים (<0.1%).
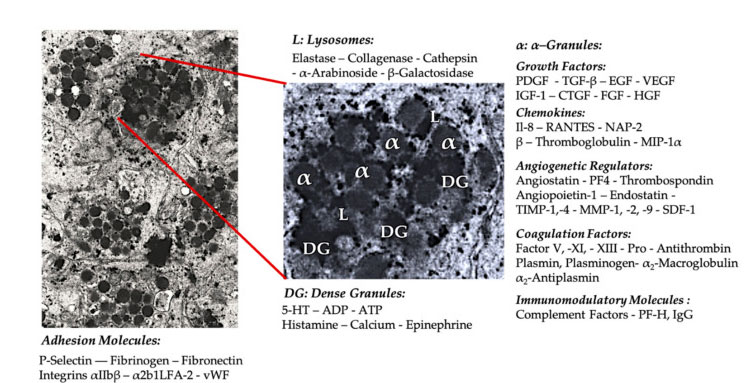
גרגיר טסיות דם
ביישום ה- PRP הקליני המוקדם, α- גרגירים הם המבנה הפנימי הנפוץ ביותר לטסיות הדם, מכיוון שהם מכילים גורמי קרישה, מספר גדול של רגולטורים PDGF ואנגיוגניים, אך יש להם תפקוד תרומבוגני מועט.גורמים אחרים כוללים רכיבי כימוקין וציטוקין פחות ידועים, כמו גורם טסיות דם 4 (PF4), חלבון בסיסי לפני טסיות הדם, P-selectin (מפעיל של אינטגרטין) וכימוקין ראנטס (מוסדר על ידי הפעלה, ביטוי תאי T רגילים וככל הנראה מַפרִישׁ).הפונקציה הכוללת של רכיבי גרגיר טסיות הדם הללו היא לגייס ולהפעיל תאים חיסוניים אחרים או לגרום לדלקת תאי אנדותל.
רכיבים גרגירים צפופים כמו ADP, סרוטונין, פוליפוספט, היסטמין ואדרנלין משמשים באופן מרומז יותר כוויסות להפעלת טסיות דם ופקקת.והכי חשוב, לרבים מהאלמנטים הללו יש את התפקוד של שינוי תאי חיסון.טסיות הדם ADP מוכרות על ידי קולטן P2Y12ADP בתאים דנדריטים (DC), ובכך מגדיל את האנדוציטוזיס האנטיגן.DC (אנטיגן המציג תא) חשוב מאוד ליזום תגובה חיסונית של תאי T ולקרה על תגובה חיסונית מגנה, המקשרת בין מערכת החיסון המולדת ומערכת החיסון הסתגלות.בנוסף, טסיות אדנוזין טריפוספט טסיות (ATP) שולח אותות דרך קולטן תאי T P2X7, מה שמוביל להגברת ההבחנה של תאי עוזר CD4 T לתאי עוזר T דלקתיים 17 (Th17).רכיבי גרגיר צפופים אחרים של טסיות הדם (כמו גלוטמט וסרוטונין) גורמים נדידת תאי T ומגדילים את ההתמיינות במונוציטים ל- DC, בהתאמה.ב- PRP, מודולי חיסון אלה הנגזרים מחלקיקים צפופים מועשרים מאוד ויש להם תפקודים חיסוניים משמעותיים.
מספר האינטראקציות הפוטנציאליות הישירות והעקיפות בין טסיות הדם לתאים אחרים (קולטן) הוא נרחב.לפיכך, יישום PRP בסביבת הרקמות הפתולוגיות המקומיות יכול לגרום למגוון השפעות דלקתיות.
ריכוז טסיות הדם
C-PRP צריך להכיל מינונים קליניים של טסיות דם מרוכזות כדי לייצר השפעות טיפוליות מועילות.טסיות הדם ב- C-PRP צריכות לעורר את התפשטות התאים, לסינתזה של גורמים מזנכימליים ונוירוטרופיים, לקדם את נדידת התאים הכימוטקטיים ולעורר פעילות חיסונית, כפי שמוצג באיור.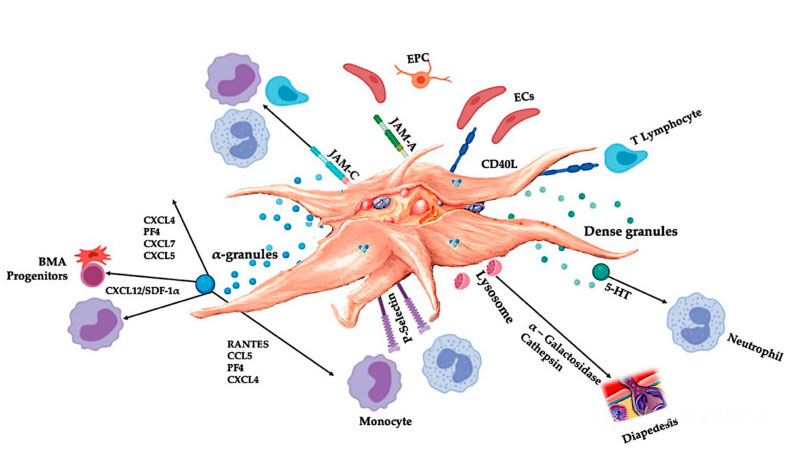
טסיות דם מופעלות, שחרור של מולקולות PGF ומולקולות הדבקה מתווכות מגוון של אינטראקציות תאים: כימוטקסיס, הידבקות תאים, נדידה ובידול תאים, ומווסת את פעילויות הרגולציה החיסונית.אינטראקציות תאי טסיות דם אלה תורמות לאנגיוגנזה ולפעילות דלקתית, ובסופו של דבר מעוררות את תהליך תיקון הרקמות.קיצורים: BMA: ASPIRATE מח העצם, EPC: תאי אבות אנדותל, EC: תאי אנדותל, 5-HT: 5-הידרוקסיטריפטמין, ראנטס: ויסות מופעל של ביטוי תאי T רגיל והפרשה משוערת, ריבה: סוג של מולקולת צומת, CD40L: אשכול: אשכול של אשכול, ריבה: צומת הדבקה, CD40L: Cluster Cluster Cluster Cluster Cluster Cluster Cluster Cluster Cluster. 40 ליגנד, SDF-1 α : גורם הנגזר תאי-סטרומה 1 α , CXCL: כימוקין (מוטיב CXC) ליגנד, PF4: גורם טסיות דם 4. מותאם מ- Everts et al.
מרקס היה האדם הראשון שהוכיח כי ריפוי עצם ורקמות רכות שופר, וספירת הטסיות המינימלית הייתה 1 × 10 6 /μL。 תוצאות אלה אושרו במחקר שנערך על היתוך המותני דרך פורמן בין -חולייתי, כאשר מינון הטסיות היה גדול יותר מאשר 1.3 × ב 106 טסיות דם/μ L, מחקר זה הדגים יותר מיזוג.בנוסף, Giusti et al.נחשף 1.5 × מנגנון תיקון הרקמות במינון של 109 דורש טסיות דם/מ"ל כדי לגרום לאנגיוגנזה תפקודית באמצעות פעילות תאי אנדותל.במחקר האחרון, ריכוזים גבוהים יותר הפחיתו את הפוטנציאל האנגיוגנזה של טסיות הדם בזקיקים ובסביבתו.בנוסף, נתונים קודמים הראו כי המינון של PRP ישפיע גם על תוצאות הטיפול.לפיכך, על מנת לגרום באופן משמעותי לתגובת האנגיוגנזה ולעורר את התפשטות התאים והגירה של תאים, C-PRP צריך להכיל לפחות 7.5 בבקבוק טיפול PRP 5 מ"ל × 10 9 יכול לספק טסיות דם.
בנוסף לתלות במינון, נראה כי ההשפעה של PRP על פעילות התא תלויה בזמן מאוד.סופי ואח '.תוצאות אלה מראות כי חשיפה לטווח הקצר לליזטים של טסיות דם אנושיות יכולה לעורר את התפשטות תאי העצם וכימוטקסיס.נהפוך הוא, חשיפה לטווח הארוך ל- PRP תוביל לרמות נמוכות יותר של פוספטאז אלקליין ויצירת מינרלים.
תא דם אדום
תאי דם אדומים אחראים להובלת חמצן לרקמות והעברת פחמן דו חמצני מהרקמות לריאות.אין להם גרעין והם מורכבים ממולקולות Heme הנקשרים לחלבונים.רכיבי הברזל וה- Heme בתאי דם אדומים מקדמים את השילוב של חמצן ופחמן דו חמצני.באופן כללי, מחזור החיים של כדוריות הדם האדומות הוא בערך 120 יום.הם מוסרים מהמחזור על ידי מקרופאגים בתהליך הנקרא RBC הזדקנות.תאי דם אדומים בדגימות PRP עלולים להיפגע בתנאי גזירה (למשל, ניתוח דימום בדם מלא, תהליך בתיווך חיסוני, לחץ חמצוני או ערכת ריכוז PRP לא מספקת).לפיכך, קרום תאי RBC מתפרק ומשחרר את המוגלובין רעיל (HB), נמדד על ידי המוגלובין ללא פלזמה (PFH), heme וברזל.].PFH ומוצרי ההשפלה שלו (HEME וברזל) מובילים במשותף להשפעות מזיקות וציטוטוקסיות על רקמות, מה שמוביל ללחץ חמצוני, אובדן תחמוצת החנקן, הפעלת מסלולי דלקת ודיכוי חיסוני.השפעות אלה יובילו בסופו של דבר לתפקוד לקוי של מיקרו -סירקולציה, התכווצות כלי דם מקומית ופגיעה בכלי הדם, כמו גם נזק לרקמות קשה.
הדבר החשוב ביותר הוא שכאשר RBC המכיל C-PRP מועבר לרקמה, הוא יגרום לתגובה מקומית הנקראת אריפטוזיס, שתגרום לשחרור של מעכב נדידת ציטוקין ומקרופאג יעיל.ציטוקין זה מעכב את נדידת המונוציטים והמקרופאגים.זה מפעיל אותות פרו-דלקתיים חזקים לרקמות הסובבות, מעכב את נדידת תאי הגזע ושגשוג פיברובלסט ומוביל לתפקוד משמעותי של תאים מקומיים.לכן חשוב להגביל את זיהום ה- RBC בתכשירי PRP.בנוסף, מעולם לא נקבע תפקידם של תאי דם אדומים בהתחדשות רקמות.תהליך הצנטריפוגה והכנת C-PRP מספק בדרך כלל יפחית או אפילו יבטל את נוכחותם של כדוריות דם אדומות, ובכך להימנע מההשלכות השליליות של המוליזה ופוליציטמיה.
לויקוציטים ב- C-PRP
נוכחותם של תאי דם לבנים בתכשירי PRP תלויה בציוד הטיפול ובתכנית ההכנה.בציוד PRP מבוסס פלזמה, תאי דם לבנים מבוטלים לחלוטין;עם זאת, תאי דם לבנים התרכזו באופן משמעותי בהכנת PRP של שכבה חומה של שקיעת אריתרוציטים.בשל מנגנוני ההגנה החיסוניים והמארחים שלה, תאי דם לבנים משפיעים מאוד על הביולוגיה הפנימית של תנאי רקמות חריפות וכרוניות.תכונות אלה יידונו בהמשך.לפיכך, נוכחות של לויקוציטים ספציפיים ב- C-PRP יכולה לגרום לתופעות סלולריות ורקמות משמעותיות.ליתר דיוק, מערכות שכבה חומות-צה-צהוביות שונות של אריתרוציטים PRP משתמשות בתכניות הכנה שונות, ובכך מייצרות חלק שונה של נויטרופילים, לימפוציטים ומונוציטים ב- PRP.לא ניתן למדוד אאוזינופילים ובסופילים בתכשירי PRP מכיוון שממברנות התא שלהם שבירים מכדי לעמוד בכוחות העיבוד הצנטריפוגליים.
נויטרופילים
נויטרופילים הם לויקוציטים חיוניים במסלולי ריפוי רבים.מסלולים אלה משתלבים עם חלבונים אנטי -מיקרוביאלים שנמצאים בטסיות דם ליצירת מחסום צפוף כנגד פתוגנים פולשניים.קיומם של נויטרופילים נקבע על פי יעד הטיפול של C-PRP.רמות מוגברות של דלקת ברקמות עשויות להידרש בטיפול ביולוגי PRP לטיפול פצעים כרוני או ביישומים שמטרתם לצמיחת עצם או לריפוי.חשוב לציין כי פונקציות נויטרופיליות נוספות נמצאו במספר מודלים, מה שמדגיש את תפקידם באנגיוגנזה ובתיקון רקמות.עם זאת, נויטרופילים יכולים גם לגרום להשפעות מזיקות, ולכן הם אינם מתאימים ליישומים מסוימים.ג'ואו וואנג הוכיחו כי השימוש ב- PRP עשיר בנויטרופילים יכול להוביל לעלייה ביחס של קולגן מסוג III לקולגן מסוג I, ובכך להחמיר פיברוזיס ולהפחתת חוזק הגיד.מאפיינים מזיקים אחרים המתווכים על ידי נויטרופילים הם שחרורם של ציטוקינים דלקתיים ומטריקס מטלופרוטאינזים (MMPs), שיכולים לקדם דלקת וקטבוליזם כאשר הם מיושמים על רקמות.
Leukomonocyte
ב- C-PRP, לימפוציטים T Mononuclear T ו- B מרוכזים יותר מכל תאי דם לבנים אחרים.הם קשורים קשר הדוק לחסינות אדפטיבית ציטוטוקסית בתיווך תאים.לימפוציטים יכולים לעורר תגובות תאים כדי להילחם בזיהום ולהסתגל לפולשים.בנוסף, ציטוקינים נגזרים ב- T-Lymphocyte (אינטרפרון- γ [IFN- γ] ו- Interleukin-4 (IL-4) משפרים את הקיטוב של מקרופאגים. Verassar et al. מודל העכבר על ידי ויסות הבידול של מונוציטים ומקרופאגים.
מונוציט - תא תיקון רב -פוטנציאלי
על פי מכשיר ההכנה של PRP ששימש, מונוציטים עשויים לבלוט או לא להתקיים בבקבוק הטיפול ב- PRP.לרוע המזל, הביצועים שלהם ויכולת ההתחדשות שלהם נדונים לעיתים רחוקות בספרות.לכן, מעט תשומת לב מוקדשת למונוציטים בשיטת ההכנה או בנוסחה הסופית.קבוצת המונוציטים הטרוגנית, שמקורה בתאי אבות במח העצם, ומועברת לרקמות היקפיות דרך מסלול תאי גזע המטופואטיים על פי גירוי המיקרו -סביבה.במהלך הומאוסטזיס ודלקת, מונוציטים במחזור עוזבים את זרם הדם ומגויסים לרקמות פצועות או מושפלות.הם יכולים לפעול כקרופאגים (M φ) תאי אפקטור או תאי אבות.מונוציטים, מקרופאגים ותאים דנדריטים מייצגים את המערכת הפגוציטית המונונוקלרית (MPS). מאפיין אופייני של חברי פרלמנט הוא הפלסטיות של דפוס ביטוי הגנים שלה והחפיפה התפקודית בין סוגי תאים אלה.ברקמות מנוון, מקרופאגים תושבים, גורמי גדילה מקומיים, ציטוקינים פרו-דלקתיים, תאים אפופטוטיים או נמקיים ומוצרים מיקרוביאליים יוזמים מונוציטים כדי להבדיל לקבוצות תאים של MPS.נניח שכאשר C-PRP המכיל מונוציטים בעלי תשואה גבוהה מוזרק למיקרו-סביבה המקומית של המחלה, סביר להניח שהמונוציטים יבדילו ל- M φ כדי לגרום לשינויים גדולים בתאים.
ממונוציט ל- M φ בתהליך הטרנספורמציה, פנוטיפ ספציפי M φ.בעשר השנים האחרונות פותח מודל, המשלב את M φ המנגנון המורכב של ההפעלה מתואר כקיטוב של שני מצבים מנוגדים: M φ פנוטיפ 1 (M φ 1, הפעלה קלאסית) ו- M φ פנוטיפ 2 (M φ 2, הפעלה אלטרנטיבית).M φ 1 מאופיין בהפרשת ציטוקין דלקתית (IFN- γ) ותחמוצת החנקן כדי לייצר מנגנון הריגת פתוגן יעיל.M φ הפנוטיפ מייצר גם גורם צמיחת אנדותל כלי דם (VEGF) וגורם צמיחה פיברובלסט (FGF).M φ הפנוטיפ מורכב מתאים אנטי דלקתיים עם פגוציטוזיס גבוהה.M φ 2 מייצרים רכיבי מטריצה חוץ תאית, אנגיוגנזה וכימוקינים ואינטרלוקין 10 (IL-10).בנוסף להגנת הפתוגן, M φ זה יכול גם להפחית דלקת ולקדם תיקון רקמות.ראוי לציין כי M φ 2 חולק ל- M במבחנה φ 2a 、 m φ 2b ו- m φ 2. זה תלוי בגירוי.תרגום in vivo של תת -סוגים אלה קשה מכיוון שהרקמה עשויה להכיל קבוצות m φ מעורבות.מעניין לציין כי על סמך אותות סביבתיים מקומיים ורמות IL-4, ניתן להמיר M φ 1 פרו-דלקתי לקידום תיקון M φ 2。 מנתונים אלה, סביר להניח שיש ריכוזים גבוהים של מונוציטים ותכשירים m φ C-PRP עשוי לתרום לתיקון טוב יותר של רקמות מכיוון שיש להם יכולות תיקון רקמות אנטי דלקתיות ויכולות הולכת אות תאים.
הגדרה מבולבלת של שבר תאי דם לבן ב- PRP
נוכחותם של תאי דם לבנים בבקבוקי טיפול ב- PRP תלויה במכשיר ההכנה של PRP ועלולה להיות להבדלים משמעותיים.ישנם מחלוקות רבות לגבי קיומם של לויקוציטים ותרומתם למוצרי תת-PRP שונים (כמו PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF ו- L-PRF) בסקירה שנערכה לאחרונה, שישה אקראיים ניסויים מבוקרים (רמת ראיות 1) ושלושה מחקרים השוואתיים פרוספקטיביים (רמת עדויות 2) היו מעורבים 1055 חולים, מה שמצביע על כך של- LR-PRP ו- LP-PRP היו בטיחות דומה.המחבר הגיע למסקנה כי התגובה השלילית של PRP עשויה לא להיות קשורה ישירות לריכוז תאי הדם הלבנים.במחקר אחר, LR-PRP לא שינה את האינטרלוקין הדלקתי (IL-1) ב- OA ברך β 、 IL-6, IL-8 ו- IL-17).תוצאות אלה תומכות בדעה שתפקידם של לויקוציטים בפעילות הביולוגית של PRP in vivo עשוי להגיע מהמעבר בין טסיות דם לויקוציטים.אינטראקציה זו יכולה לקדם את הביוסינתזה של גורמים אחרים (כמו ליפוקסיגן), שיכולים לקזז או לקדם רגרסיה של דלקת.לאחר שחרור ראשוני של מולקולות דלקתיות (חומצה ארכידונית, לוקוטריין ופרוסטגלנדין), Lipoxygen A4 משתחרר ממיטב טסיות דם כדי למנוע הפעלה נויטרופילית.בסביבה זו פנוטיפ M φ מ- M φ 1 מתג ל- M φ 2。 בנוסף, יש עדויות הולכות וגוברות לכך שהמסתובב תאים מונונוקלריים יכולים להתמיין למגוון סוגים של תאים לא פגוציטים בגלל הפלוריפוטיות שלהם.
סוג ה- PRP ישפיע על תרבות MSC.בהשוואה לדגימות PRP או PPP טהורות, LR-PRP יכול לגרום להתפשטות גבוהה משמעותית של MSCs הנגזרים מח העצם (BMMSCs), עם שחרור מהיר יותר ופעילות ביולוגית טובה יותר של PGF.כל המאפיינים הללו תורמים להוסיף מונוציטים לבקבוק הטיפול ב- PRP ולהכיר ביכולת החיסון שלהם ופוטנציאל ההבחנה שלהם.
ויסות חיסון מולד ומסתגל של PRP
הפונקציה הפיזיולוגית המפורסמת ביותר של טסיות הדם היא לשלוט על דימום.הם מצטברים באתר נזק לרקמות ובכלי הדם הפגומים.אירועים אלה נגרמים כתוצאה מביטוי של אינטגרנים ובחירות המעוררים הידבקות וטסיות דם.האנדותל הפגוע מחמיר עוד יותר את התהליך הזה, ואת הקולגן החשוף וחלבוני מטריקס תת -תאי אחרים מקדמים את ההפעלה העמוקה של טסיות הדם.במקרים אלה הוכח התפקיד החשוב של האינטראקציה בין פון פון וילברנד (VWF) לגליקופרוטאין (GP), במיוחד GP-IB.לאחר הפעלת טסיות הדם, טסיות הדם α- 、 צפופות, ליזוזום ו- T-Granules מווסתים את האקסוציטוזיס ומשחררים את תוכנם לסביבה החוץ תאית.
מולקולת הידבקות טסיות דם
על מנת להבין טוב יותר את תפקידו של PRP ברקמות דלקתיות וטסיות דם בתגובה חיסונית, עלינו להבין כיצד קולטני שטח טסיות דם שונים (אינטגרנים) ומולקולות הדבקה של צומת (JAM) ואינטראקציות תאים יכולים ליזום תהליכים קריטיים בחסינות מולדת ומסתגלת.
אינטגרנים הם מולקולות הדבקה של פני התא הנמצאות בסוגי תאים שונים ומובעות בכמויות גדולות על טסיות הדם.האינטגרנים כוללים A5B1, A6B1, A2B1 LFA-2, (GPIA/IIA) ו- AIIBB3 (GPIIB/IIIA).בדרך כלל הם קיימים במצב סטטי ונמוך זיקה.לאחר ההפעלה הם עוברים למצב של זיקה מחייבת ליגנד גבוהה.לאינטגרנים יש פונקציות שונות על טסיות הדם ומשתתפות באינטראקציה של טסיות הדם עם מספר סוגים של תאי דם לבנים, תאי אנדותל ומטריצה חוץ תאית.בנוסף, קומפלקס GP-IB-V-IX בא לידי ביטוי על קרום הטסיות והוא הקולטן העיקרי לקשירה עם VWF VON.אינטראקציה זו מתווכת את המגע הראשוני בין טסיות הדם למבני תת -תותל חשופים.מתחם האינטגרטין וה- GP קשורים לתהליכים דלקתיים שונים וממלאים תפקיד חשוב בהיווצרות מתחם טסיות הדם-לוקוציטים.באופן ספציפי, אינטגרטין AIIBB3 נחוץ ליצירת קומפלקס יציב על ידי שילוב של פיברינוגן עם קולטן אנטיגן מקרופאג 1 (MAC-1) על נויטרופילים.
טסיות דם, נויטרופילים ותאי אנדותל כלי הדם מבטאים מולקולות הדבקה של תאים ספציפיים, הנקראים סלקטין.בתנאים דלקתיים, טסיות הדם מבטאות P-selectin ו- Neutrophil L-selectin.לאחר הפעלת טסיות הדם, P-selectin עשוי להיקשר לליגנד PSGL-1 שקיים על נויטרופילים ומונוציטים.בנוסף, קשירת PSGL-1 יוזמת תגובת מפל איתות תאית, המפעילה נויטרופילים דרך נויטרופיל אינטגרטין MAC-1 ואנטיגן 1 הקשור לתפקוד לימפוציטים (LFA-1).MAC-1 מופעל נקשר ל- GPIB או GPIIB/IIIA על טסיות דם דרך פיברינוגן, ובכך מייצב את האינטראקציה בין נויטרופילים לטסיות הדם.בנוסף, LFA-1 מופעל יכול לשלב עם מולקולת הדבקה בין-תאית 2 לטסיות דם 2 כדי לייצב עוד יותר את קומפלקס הטסיות הנויטרופיל כדי לקדם הדבקה לטווח הארוך עם תאים.
טסיות דם ולוקוציטים ממלאים תפקיד מפתח בתגובות חיסון מולדות ומסתגלות
הגוף יכול לזהות גופים זרים ורקמות פצועות במחלות חריפות או כרוניות כדי ליזום תגובת מפל ריפוי פצעים ומסלול דלקתי.מערכות החיסון המולדות וההסתגלות מגנות על המארח מפני זיהום, ותאי דם לבנים ממלאים תפקיד חשוב בחפיפה בין שתי המערכות.באופן ספציפי, מונוציטים, מקרופאגים, נויטרופילים ותאי רוצח טבעיים ממלאים תפקיד מפתח במערכת המולדת, ואילו לימפוציטים ותתי המשנה שלהם ממלאים תפקיד דומה במערכת החיסון האדפטיבית.
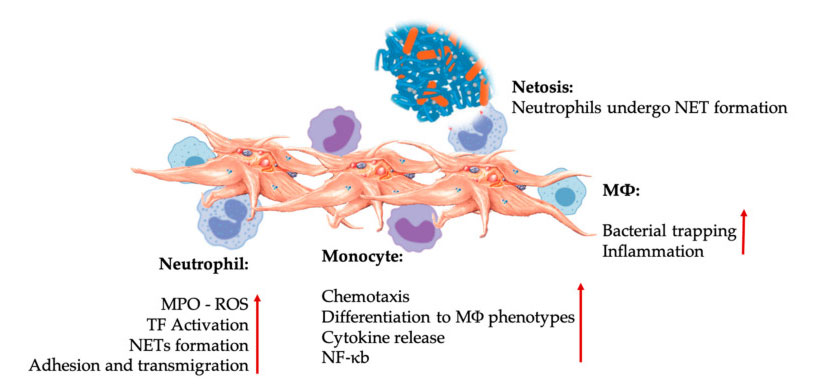
אינטראקציות טסיות דם ולוקוציטים באינטראקציות מולדות של תאי חיסון.טסיות דם מקיימות אינטראקציה עם נויטרופילים ומונוציטים, ולבסוף עם M φ אינטראקציה, התאם והגדילו את תפקודי האפקטור שלהם.אינטראקציות טסיות-לוקוציטים אלה מובילות לדלקת באמצעות מנגנונים שונים, כולל נטוזיס.קיצורים: MPO: myeloperoxidase, ROS: מיני חמצן תגובתי, TF: גורם רקמות, נטו: מלכודת חוץ תאי נויטרופילית, NF- κ B: גורם גרעיני קאפה B, M φ : מקרופאגים.
מערכת חיסון מולדת
תפקידה של מערכת החיסון המולדת הוא לזהות לא ספציפית לזהות מיקרואורגניזמים פולשניים או שברי רקמות ולעורר את פינוים.כאשר מבנים מולקולריים מסוימים הנקראים קולטני זיהוי דפוסי ביטוי פני השטח (PRR) משתלבים עם דפוסים מולקולריים הקשורים לפתוגן ודפוסים מולקולריים הקשורים לנזק, מערכת החיסון המולדת תופעל.ישנם סוגים רבים של PRRs, כולל קולטן דמוי אגרה (TLR) ו- Rig-1 כמו קולטן (RLR).קולטנים אלה יכולים להפעיל את גורם התמלול הראשי קאפה B (NF- κ B) הוא גם מווסת היבטים מרובים של תגובה חיסונית מולדת ומסתגלת.מעניין לציין כי טסיות הדם מבטאות גם מגוון של מולקולות קולטן חיסוני על פני השטח והציטופלזמה שלהם, כמו P-selectin, ליגנד CD40 חלבון טרנסממברני (CD40L), ציטוקינים (כמו IL-1 β 、 TGF-)) and ו- TLR-Specific. לכן טסיות הדם יכולות לקיים אינטראקציה עם תאי חיסון שונים.
אינטראקציה בין תאים לבנים טסיות בחסינות מולדת
כאשר טסיות הדם נכנסות או פולשות לזרם דם או לרקמות, טסיות הדם הן אחד התאים המגלים תחילה פגיעה באנדותל ופתוגנים מיקרוביאליים.צבירת טסיות דם ומקדמת את שחרורם של אגוניסטים של טסיות הדם ADP, תרומבין ו- VWF, וכתוצאה מכך הפעלת טסיות דם וביטוי של קולטני כימוקין טסיות C, CC, CXC ו- CX3C, ובכך גורמים לטסיות דם באתר או בפציעה.
מערכת החיסון המולדת נקבעת מראש גנטית לגילוי פולשים, כמו נגיפים, חיידקים, טפילים ורעלים, או פצעים ופצעים ברקמות.זוהי מערכת לא ספציפית, מכיוון שכל פתוגן יזוהה כזר או לא עצמי וממוקם במהירות.מערכת החיסון המולדת מסתמכת על קבוצה של חלבונים ופגוציטים, המזהים את המאפיינים השמורים היטב של פתוגנים ומפעילים במהירות את התגובה החיסונית כדי לסייע בחיסול הפולשים, גם אם המארח מעולם לא נחשף לפתוגנים ספציפיים לפני כן.
נויטרופילים, מונוציטים ותאים דנדריטים הם תאי החיסון המולדים הנפוצים ביותר בדם.הגיוס שלהם נחוץ לתגובה חיסונית מוקדמת נאותה.כאשר משתמשים ב- PRP ברפואה רגנרטיבית, אינטראקציה בין תאים לבנים טסיות מווסתת דלקת, ריפוי פצעים ותיקון רקמות.TLR-4 על טסיות הדם מגרה אינטראקציה בין טסיות דם-נויטרופיל, המסדירה את מה שמכונה פרץ חמצוני לויקוציטים על ידי ויסות שחרורם של מיני חמצן תגובתי (ROS) ומיילופרוקסידאז (MPO) מנויטרופילים.בנוסף, האינטראקציה בין טסיות דם-נויטרופיל לבין ניטרופיל נויטרופיל מובילה להיווצרות מלכודות נויטרופיל-תאי (NETS).רשתות מורכבות מגרעין נויטרופיל ותכנים תוך -תאיים אחרים נויטרופיליים, שיכולים לתפוס חיידקים ולהרוג אותם באמצעות נטוזה.היווצרות רשתות היא מנגנון הרג חיוני של נויטרופילים.
לאחר הפעלת טסיות הדם, מונוציטים יכולים לנדוד לרקמות חולות וניווניות, שם הם מבצעים פעילויות הדבקה ולהפריש מולקולות דלקתיות העלולות לשנות תכונות כימוטקסיסיות ותכונות פרוטאוליטיות.בנוסף, טסיות הדם יכולות לגרום להפעלת NF- K-B של מונוציטים כדי לווסת את תפקוד האפקטור של מונוציטים, המהווה את המתווך העיקרי לתגובה דלקתית והפעלה ובידול של תאי חיסון.טסיות הדם מקדמות עוד יותר את פרץ החמצון האנדוגני של מונוציטים כדי לקדם את הרס הפתוגנים הפגוציטים.שחרור ה- MPO מתווך על ידי האינטראקציה הישירה בין טסיות הדם-מונוציט CD40L-MAC-1.מעניין לציין כי כאשר P-selectin מפעיל טסיות דם בתנאי רקמות דלקתיות חריפות וכרוניות, כימוקינים הנגזרים על ידי טסיות הדם PF4, RANTES, IL-1 β ו- CXCL-12 יכולים למנוע אפופטוזיס ספונטני של מונוציטים, אך לקדם את הבידול שלהם למקרופזים.
מערכת חיסון אדפטיבית
לאחר שמערכת החיסון המולדת הלא ספציפית מזהה את הנזק המיקרוביאלי או הרקמות, מערכת החיסון הספציפית הספציפית תשתלט.מערכות הסתגלות כוללות לימפוציטים B הקשורים לאנטיגן (תאי B) ולימפוציטים T קונבנציונליים (TREG) המתאמים את פינוי הפתוגנים.ניתן לחלק את תאי T באופן גס לתאי T עוזר (תאי TH) ולתאי T ציטוטוקסיים (תאי TC, הידועים גם בשם תאי רוצח T).תאים T מחולקים עוד יותר לתאי Th1, Th2 ו- Th17, בעלי תפקודי מפתח בדלקת.תאים TH יכולים להפריש ציטוקינים פרו-דלקתיים (למשל IFN- γ 、 TNF- β) ומספר אינטרלוקינים (למשל, IL-17). הם יעילים במיוחד במניעת נגיף תוך-תאי וזיהום חיידקי. תגובה חיסונית. תאי TC הם תאי אפקטור, שיכולים לחסל מיקרואורגניזמים ותאים ממוקדים תוך -תאיים וחוץ תאיים.
מעניין לציין כי תאי TH2 מייצרים IL-4 ומשפיעים על קיטוב M φ, M φ המנחה את התחדשות M φ 2 פנוטיפ, ואילו IFN- γ m φ משתנים לפנוטיפ M φ 1 דלקתי, שתלוי במינון ובזמן של ציטוקינים.לאחר הפעלת IL-4, M φ 2 גורם לתאי Treg להתמיין לתאי Th2 ואז מייצר IL-4 נוסף (לולאת משוב חיובית).תאים TH ממירים M φ הפנוטיפ מופנה לפנוטיפ המחודש בתגובה לחומרים ביולוגיים ממוצא רקמות.מנגנון זה מבוסס על העדויות לכך שתאים ממלאים תפקיד משמעותי בבקרת דלקת ותיקון רקמות.
אינטראקציה בין תאים לבנים טסיות בחסינות אדפטיבית
מערכת החיסון האדפטיבית משתמשת בקולטנים ספציפיים לאנטיגן וזוכרת שנתקלה בעבר בפתוגנים, ומשמידה אותם כאשר היא נתקלת לאחר מכן במארח.עם זאת, תגובות חיסון אדפטיביות אלה התפתחו לאט.Konias et al.זה מראה כי רכיב הטסיות תורם לתפיסת הסיכון ולתיקון רקמות, וכי האינטראקציה בין טסיות דם לויקוציטים מקדמת את הפעלת התגובה החיסון ההסתגלות.
במהלך התגובה החיסונית ההסתגלות, טסיות הדם מקדמות תגובות מונוציטים ומקרופאג באמצעות התבגרות תאי DC ו- NK, מה שמוביל לתגובות תאי T ו- B ספציפיות.לפיכך, רכיבי גרגיר הטסיות משפיעים ישירות על חסינות אדפטיבית על ידי ביטוי CD40L, מולקולה החיונית לוויסות התגובה החיסונית האדפטיבית.טסיות הדם דרך CD40L לא רק ממלאות תפקיד במצגת אנטיגן, אלא גם משפיעות על תגובת תאי T.Liu et al.נמצא כי טסיות הדם מווסתות את תגובת תאי CD4 T באופן מורכב.ויסות דיפרנציאלי זה של קבוצות משנה תאי CD4 T פירושו כי טסיות הדם מקדמות תאי CD4 T כדי להגיב לגירויים דלקתיים, ובכך מייצרים תגובות פרו-דלקתיות ואנטי-דלקתיות חזקות.
טסיות הדם מווסתות גם תגובה אדפטיבית בתיווך תאי B לפתוגנים מיקרוביאליים.ידוע כי CD40L על תאי CD4 T שהופעלו יפעיל CD40 של תאי B, ויספק את האות השני הנדרש להפעלת לימפוציטים B תלויים בתאי T, המרה של אלוטיפ לאחר מכן, והפרת תאי B.באופן כללי, התוצאות מראות בבירור את הפונקציות השונות של טסיות הדם בחסינות אדפטיבית, מה שמצביע על כך שטסיות הדם מחברות בין האינטראקציה בין תאי T לתאי B דרך CD40-CD40L, ובכך משפרות את תגובת תאי B התלויה בתאי T.בנוסף, טסיות הדם עשירות בקולטני פני התא, שיכולים לקדם הפעלת טסיות דם ולשחרר מספר גדול של מולקולות פעילות דלקתיות וביולוגיות המאוחסנות בחלקיקי טסיות דם שונים, ובכך משפיעים על התגובה החיסונית המולדת והסתגלית.
התפקיד המורחב של סרוטונין הנגזר בטסיות דם ב- PRP
לסרוטונין (5-hydroxytryptamine, 5-HT) יש תפקיד מפתח ברור במערכת העצבים המרכזית (CNS), כולל סובלנות לכאב.ההערכה היא כי מרבית ה- 5-HT האנושי מיוצר בדרכי העיכול ואז דרך זרימת הדם, שם הוא נספג על ידי טסיות דם באמצעות טרנספורטר ספיגה מחדש של סרוטונין ונשמר בחלקיקים צפופים בריכוז גבוה (65 מ"מ/ל ').5-HT הוא מעבירה עצבית ידועה והורמון המסייעים בוויסות תהליכים נוירו-פסיכולוגיים שונים ב- CNS (מרכז 5-HT).עם זאת, מרבית ה- 5-HT קיים מחוץ למערכת העצבים המרכזית (5-HT היקפית), והוא מעורב בוויסות הפונקציות הביולוגיות המערכיות והתאיות של מערכות איברים מרובים, כולל מערכות פונקציונליות קרדיווסקולריות, ריאות, מערכת העיכול, אורוגניטל וטסיות דם.ל- 5-HT יש מטבוליזם תלוי ריכוז על מגוון סוגי תאים, כולל אדיפוציטים, תאי אפיתל ותאי דם לבנים.5-HT היקפי הוא גם מודולטור חיסוני רב עוצמה, שיכול לעורר או לעכב דלקת ולהשפיע על תאי חיסון שונים באמצעות הקולטן הספציפי שלו ל- 5-HT (5HTR).
מנגנון פרצרין ואוטוקריני של HT
הפעילות של 5-HT מתווכת על ידי האינטראקציה שלה עם 5HTRs, שהיא סופר-משפחתית עם שבעה חברים (5-HT 1-7) ולפחות 14 תת-סוגים שונים של קולטנים, כולל החבר 5-HT 7, ההיקפי שלה, ההיקפי שלה והן. פונקציה בניהול כאבים.בתהליך של ניגול טסיות דם, טסיות הדם המופעלות מפרישות מספר גדול של 5-HT הנגזרים על ידי טסיות הדם, שיכולות לקדם התכווצות כלי הדם ולעורר את הפעלת טסיות הדם הסמוכות ולימפוציטים באמצעות ביטוי של 5-HTR על תאי אנדותל, תאי שריר חלקים ותאי חלקים ותאי חלק חלק תאים חיסוניים.Pacala et al.נבדקה ההשפעה המיטוטית של 5-HT על תאי אנדותל כלי הדם, ונקבע הפוטנציאל לקידום צמיחת כלי הדם הפגומים על ידי גירוי אנגיוגנזה.כיצד מוסדרים תהליכים אלה אינו ברור לחלוטין, אך הוא עשוי להיות כרוך במסלולי אות דו כיווניים דיפרנציאליים במיקרו-מעגל הרקמות כדי לווסת את תפקודי תאי האנדותל כלי הדם ותאי שריר חלק, פיברובלסטים ותאי חיסון באמצעות קולטנים 5-HT ספציפיים על תאים אלה .התפקוד האוטוקריני של טסיות הדם 5-HT לאחר הפעלת טסיות הדם תואר [ref].שחרורו של 5-HT משפר את הפעלת טסיות הדם ואת גיוס טסיות הדם המסתובבות, מה שמוביל להפעלת תגובות מפל האות והמשפיעים במעלה הזרם התומכים בתגובה לטסיות הדם.
אפקט 5-HT חיסוני 5-HT
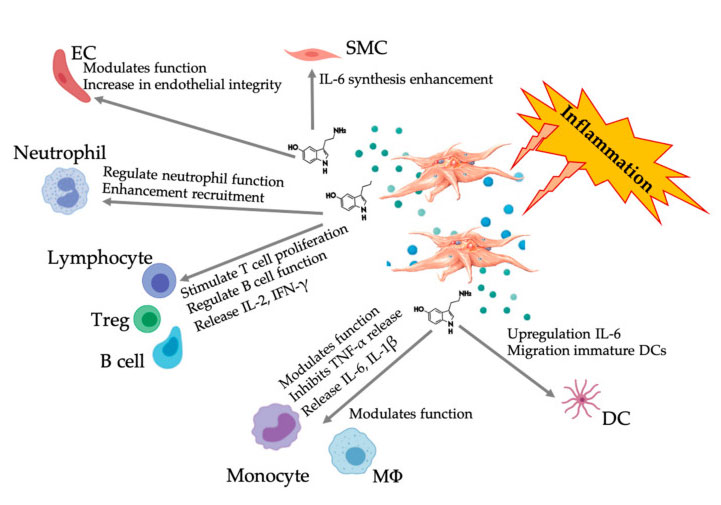
יותר ויותר עדויות מראות כי סרוטונין יכול למלא תפקיד ב- 5HT שונה כמודולטור חיסוני.על פי ה- 5HT שבא לידי ביטוי בלוקוציטים שונים המעורבים בתגובה דלקתית, 5-HT הנגזרים על ידי טסיות הדם כווסת חיסונית במערכות חיסון מולדות ומסתגלות כאחד.5-HT יכול לעורר את התפשטות ה- Treg ולווסת את תפקודי תאי B, תאי רוצח טבעיים ונויטרופילים על ידי גיוס DC ומונוציטים לאתר הדלקתי.מחקרים אחרונים הראו כי 5-HT הנגזרים מהטסיות יכול לווסת את תפקודם של תאי חיסון בתנאים ספציפיים.לפיכך, באמצעות C-PRP, ריכוז הטסיות גדול מ- 1 × 10 6/μ L יכול לעזור באופן משמעותי בהובלת הריכוז של 5-HT הנגזר ממיטב טסיות גדולות לרקמה.בסביבת המיקרו המאופיינת ברכיבים דלקתיים, PRP יכול לקיים אינטראקציה עם מספר תאים חיסוניים הממלאים תפקיד מפתח בפתולוגיות אלה, מה שעשוי להשפיע על התוצאות הקליניות.
איור המציג את התגובה הרב-גונית של 5-HT לאחר הפעלת טסיות דלקת PRP דלקתיות.לאחר הפעלת טסיות הדם, טסיות הדם משחררות את גרגירין, כולל 5-HT בגרגירים צפופים, שיש לה מגוון רחב של השפעות דיפרנציאליות על תאי חיסון שונים, תאי אנדותל ותאי שריר חלק.קיצורים: SMC: תאי שרירים חלקים, EC: תאי אנדותל, TREG: לימפוציטים T קונבנציונליים, M φ : מקרופאגים, DC: תאים דנדריטים, IL: אינטרלוקין, IFN- γ : אינטרפרון γ。 שונו והתמודדו מ- Everts et al.ו- Hull et al.
השפעה משכך כאבים של PRP
טסיות דם מופעלות ישחררו מתווכים פרו-דלקתיים ואנטי דלקתיים רבים, אשר יכולים לא רק לגרום לכאב, אלא גם להפחית את הדלקת והכאב.לאחר יישום, דינמיקת הטסיות האופיינית של PRP משנה את המיקרו -סביבה לפני תיקון והתחדשות רקמות באמצעות מגוון מסלולים מורכבים הקשורים לאנבוליזם וקטבוליזם, התפשטות תאים, בידול ויסות תאי גזע.מאפיינים אלה של PRP מובילים ליישום PRP במצבים פתולוגיים קליניים שונים הקשורים בדרך כלל לכאבים כרוניים (כמו פגיעה בספורט, מחלה אורטופדית, מחלת עמוד השדרה ופצע כרוני מורכב), אם כי המנגנון המדויק לא נקבע במלואו.
בשנת 2008, Evertz et al.זהו הניסוי המבוקר האקראי הראשון שדיווח על ההשפעה המשכך כאבים של הכנת PRP, המוכנה מהשכבה החומה של קצב המשקעים האריתרוציטים האוטולוגיים ומופעלת באמצעות טרומבין אוטולוגי לאחר ניתוח הכתפיים.הם ציינו ירידה משמעותית בציוני הסולם האנלוגי הוויזואלי, השימוש במשככי כאבים מבוססי אופיואידים ושיקום מוצלח יותר לאחר הניתוח.ראוי לציין כי הם משקפים את ההשפעה המשכך כאבים של טסיות הדם המופעלות ומשלבים על המנגנון של טסיות הדם המשחררות 5-HT.בקיצור, טסיות הדם רדומות ב- PRP שהוכן טרי.לאחר הפעלת טסיות הדם באופן ישיר או עקיף (גורם רקמות), טסיות הדם משנות צורה ומייצרות שווא מספיק כדי לקדם צבירת טסיות דם.לאחר מכן, הם משחררים חלקיקים α- וצפופים תוך-תאיים.הרקמה המטופלת ב- PRP מופעלת תפלש על ידי PGF, ציטוקינים וליזוזומים טסיות אחרות.ליתר דיוק, כאשר חלקיקים צפופים משחררים את תוכנם, הם ישחררו כמות גדולה של 5-HT המסדירה כאב.ב- C-PRP, ריכוז הטסיות גבוה פי 5 עד 7 מזה בדם היקפי.לפיכך, שחרורו של 5-HT מטסיות דם הוא אסטרונומי.מעניין, Sprott et al.הדו"ח ציין כי הכאב הוקל באופן משמעותי לאחר דיקור סיני ומוקסיבציה, ריכוז הטסיות הנגזרות 5-HT הופחת באופן משמעותי, ואז עלה רמת הפלזמה של 5-HT.
בהיקפי, טסיות הדם, תאי התורן ותאי האנדותל ישחררו 5-HT אנדוגני במהלך פגיעה ברקמות או טראומה כירורגית.מעניין לציין כי מגוון של קולטנים של 5-HT של נוירונים התגלו באזור ההיקפי, אשר אישר כי 5-HT יכול להפריע להעברה הנוציציתית באזור ההיקפי.מחקרים אלה מראים כי 5-HT יכול להשפיע על העברת הרקמות ההיקפיות של הרקמות ההיקפיות דרך קולטנים 5-HT1, 5-HT2, 5-HT3, 5-HT4 ו- 5-HT7.
מערכת 5-HT מייצגת מערכת חזקה שיכולה להפחית ולהגדיל את מידת הכאב לאחר גירוי מזיק.דווח על הוויסות המרכזי וההיקפי של אותות Nociceptive ושינויים במערכת 5-HT בחולים עם כאבים כרוניים.בשנים האחרונות, מספר גדול של מחקרים התמקדו בתפקיד 5-HT ובקולטנים בהתאמה בעיבוד ובוויסות מידע מזיק, וכתוצאה מכך תרופות כמו מעכבי ספיגה חוזרת של סרוטונין סלקטיבית (SSRI).תרופה זו מעכבת את הספיגה המחודשת של סרוטונין לנוירונים presynaptic לאחר שחרורו של סרוטונין.זה משפיע על משך ועוצמת התקשורת הסרוטונין ומהווה טיפול אלטרנטיבי לכאב כרוני.יש צורך במחקר קליני נוסף בכדי להבין בבירור את המנגנון המולקולרי של ויסות הכאב 5-HT הנגזר מ- PRP במחלות כרוניות וניווניות.
ניתן להשיג נתונים אחרים לפיתרון ההשפעה המשכך כאבים של PRP לאחר בדיקת מודל בעלי החיים המשכך כאבים.המסקנות הסטטיסטיות ההשוואתיות במודלים אלה מאתגרות מכיוון שמחקרים אלה מכילים משתנים רבים מדי.עם זאת, כמה מחקרים קליניים התייחסו להשפעות Nociceptive ומשכך כאבים של PRP.מספר מחקרים הראו כי חולים שקיבלו טיפול בגידולים או דמעות שרוול מסובב סובלים מהקלה רבה על כאבים.לעומת זאת, מספר מחקרים אחרים הראו כי PRP יכול להפחית או אפילו לחסל את הכאב של חולים עם ניוון גידים, OA, פשיטיס פלנטרי ומחלות כף רגל וקרסול אחרות.ריכוז הטסיות הסופיות והרכב התאים הביולוגיים זוהו כמאפייני ה- PRP העיקריים, המסייעים להתבונן בהשפעה המשכך כאבים עקבית לאחר יישום PRP.משתנים אחרים כוללים שיטת אספקת PRP, טכנולוגיית יישומים, פרוטוקול הפעלת טסיות דם, רמת פעילות ביולוגית של PGF וציטוקינים ששוחררו, סוג רקמות של יישום PRP וסוג פציעה.
ראוי לציין כי קופלר פתר את הפוטנציאל של PRP בהקלת כאבים בקרב חולים עם כאבים נוירופתיים כרוניים קלים עד חמורים, המשניים לעצב הלא-מתחדש הפגוע.מטרת המחקר היא לחקור האם ניתן להפחית או לשכוך את הכאב הנוירופתי עקב קידום התחדשות אקסונאלית של PRP ושיבה מחדש של עצבי היעד.באופן מפתיע, בקרב החולים שקיבלו טיפול, כאבים נוירופתיים עדיין מבוטלים או מקלים לפחות שש שנים לאחר הניתוח.בנוסף, כל החולים החלו להקל על הכאב תוך שלושה שבועות לאחר יישום PRP.
לאחרונה נצפו השפעות PRP משכך כאבים דומות בתחום הפצעים לאחר הניתוח וטיפול בעור.מעניין לציין כי המחברים דיווחו על ההיבטים הפיזיולוגיים של כאבי פצעים הקשורים לפגיעה בכלי הדם והיפוקסיה של רקמות העור.הם גם דנו בחשיבותה של אנגיוגנזה במיטוב חמצן ומסירה מזינה.המחקר שלהם הראה כי בהשוואה לקבוצת הביקורת, חולים שקיבלו טיפול ב- PRP סבלו פחות מכאבים והגדילו משמעותית את האנגיוגנזה.לבסוף, ג'והל ועמיתיו ביצעו סקירה שיטתית ומטא-אנליזה והגיעו למסקנה כי PRP יכול להפחית כאבים לאחר שימוש ב- PRP באינדיקציות אורטופדיות, במיוחד בחולים שקיבלו אפיקונדיליטיס חיצונית וטיפול ב- OA בברך.לרוע המזל, מחקר זה לא ציין את ההשפעות של תאי דם לבנים, ריכוז טסיות הדם או השימוש במפעילי טסיות דם אקסוגניות, מכיוון שמשתנים אלה ישפיעו על היעילות הכוללת של PRP.ריכוז הטסיות האופטימלי של PRP להקלה על הכאב המרבי אינו ברור.במודל העכברוש של הגידול, ריכוז הטסיות היה 1.0 × 10 6 / מיקרו ב- L, ניתן להקל לחלוטין על הכאב, בעוד שההקלה על הכאב הנגרמת על ידי PRP עם מחצית מריכוז הטסיות מופחתת באופן משמעותי.לכן אנו מעודדים מחקרים קליניים נוספים לחקור את ההשפעות המשכך כאבים של תכשירים שונים של PRP.
אפקט PRP ואנגיוגנזה
תכשירים C-PRP ברפואה רגנרטיבית מדויקת מאפשרות מסירת ביו-מולקולות שמשתחררות על ידי ריכוזים גבוהים של טסיות דם המופעלות באתרי רקמות יעד.לפיכך, נפתחו מגוון של תגובות מפל, התורמות לוויסות חיסון באתר, תהליך דלקתי ואנגיוגנזה לקידום ריפוי ותיקון רקמות.
אנגיוגנזה היא תהליך רב-שלבי דינאמי הכולל נביטה ומיקרו-רקמות מכלי דם קיימים.אנגיוגנזה התקדם בגלל מגוון מנגנונים ביולוגיים, כולל נדידת תאי אנדותל, התפשטות, בידול וחלוקה.תהליכים סלולריים אלה הם תנאים מוקדמים ליצירת כלי דם חדשים.הם חיוניים לצמיחת כלי הדם הקיימים מראש להחזרת זרימת הדם ולתמוך בפעילות המטבולית הגבוהה של תיקון רקמות והתחדשות רקמות.כלי דם חדשים אלה מאפשרים מסירת חמצן וחומרים מזינים, והסרת תוצרי לוואי מרקמות מטופלות.
פעילות אנגיוגנזה מווסתת על ידי גירוי גורם אנגיוגני VEGF וגורמים אנטי-אנגיוגניים (למשל, אנגיוסטטין וטרומבוספונדין -1 [TSP-1]).במיקרו -סביבת המיקרו -סביבתית החולה והמושפל (כולל מתח חמצן נמוך, pH נמוך ורמת חומצה לקטית גבוהה), גורמים אנגיוגניים מקומיים יחזירו את פעילות האנגיוגנזה.
מספר מדיה מסיסת טסיות דם, כמו FGF בסיסית ו- TGF- β ו- VEGF יכולים לעורר תאי אנדותל לייצור כלי דם חדשים.Landsdown ו- Fortier דיווחו על תוצאות שונות הקשורות להרכב PRP, כולל המקורות תוך -טסיות של רגולטורים אנגיוגניים רבים.בנוסף, הם הגיעו למסקנה כי עליית האנגיוגנזה תורמת לריפוי של מחלות MSK באזורים עם כלי דם לקויים, כמו קרע מניסקוס, פגיעה בגידים ואזורים אחרים עם כלי הדם לקוי.
קידום ותכונות טסיות דם אנטי-אנגיוגניות
בעשורים האחרונים, מחקרים שפורסמו הוכיחו כי טסיות הדם ממלאות תפקיד מפתח בהמוסטזיס ראשוני, היווצרות קריש דם, גורם גדילה ושחרור ציטוקין ובוויסות אנגיוגנזה כחלק מתהליך תיקון הרקמות.באופן פרדוקסאלי, PRP α- הגרגירים מכילים ארסנל של גורמי צמיחה פרו-אנגיוגניים, חלבונים אנטי-אנגיוגניים וציטוקינים (כמו PF4, מעכב מפעיל פלסמינוגן 1 ו- TSP-1), ומכוונים לשחרור של גורמים ספציפיים הממלאים תפקיד .תפקיד באנגיוגנזה.לפיכך, תפקידו של PRP בבקרת ויסות אנגיוגנזה עשוי להיות מוגדר על ידי הפעלת קולטני פני התא הספציפיים, TGF- β יוזמים תגובות פרו-אנגיוגניות ואנטי-אנגיוגניות.היכולת של טסיות הדם להפעיל מסלול אנגיוגנזה אושרה באנגיוגנזה פתולוגית ובאנגיוגנזה של הגידול.
גורם צמיחה אנגיוגני שמקורו בטסיות טסיות וגורם צמיחה אנטי-אנגיוגני, הנגזר ממולקולות α וצפוף ודבק.והכי חשוב, בדרך כלל מקובל כי ההשפעה הכוללת של טסיות הדם על אנגיוגנזה היא פרו-אנגיוגנית ומעוררת.צפוי שטיפול ב- PRP ישלוט בהשראת אנגיוגנזה, שתתרום להשפעת הטיפול של מחלות רבות, כמו ריפוי פצעים ותיקון רקמות.מתן PRP, ליתר דיוק מתן ריכוז גבוה PGF וציטוקינים טסיות דם אחרים, יכול לגרום לאנגיוגנזה, אנגיוגנזה וטרטריוגנזה, מכיוון שגורם הנגזר תאי סטרומה נקשר לקולטן CXCR4 בתאי אבות אנדותל.ביל ואח '.מוצע כי PRP מגביר את הניאו -וסקולריזציה האיסכמית, העשויה לנבוע מגירוי של אנגיוגנזה, אנגיוגנזה וטרטרוגנזה.במודל המבחנה שלהם, התפשטות תאי האנדותל והיווצרות הנימים נגרמו על ידי מספר גדול של PDGs שונים, מהם VEGF היה הממריץ האנגיוגני העיקרי.גורם חשוב וחיוני נוסף לשיקום מסלול האנגיוגנזה הוא הסינרגיה בין מספר PGFs.ריצ'רדסון ואח '.הוכח כי הפעילות הסינרגיסטית של גורם צמיחה נגזר על ידי גורם אנגיוגני הנגזרים על טסיות הדם (PDGF-BB) ו- VEGF הובילה להיווצרות מהירה של רשת כלי דם בוגרת בהשוואה לפעילות של גורם צמיחה אינדיבידואלי.ההשפעה המשולבת של גורמים אלה אושרה לאחרונה במחקר בנושא שיפור זרימת הביטחונות המוחית בעכברים עם היפופרפוזיה לטווח הארוך.
והכי חשוב, מחקר חוץ גופני מדד את ההשפעה ההתרבותית של תאי אנדותל וריד טבורי אנושי וריכוזי טסיות דם שונים בבחירת מכשיר הכנת PRP ואסטרטגיית מינון טסיות הדם, והתוצאות הראו שמינון הטסיות האופטימלי היה 1.5 × 10 טסיות דם/ מיקרו 50. לקידום אנגיוגנזה.ריכוז טסיות גבוה מדי עשוי לעכב את תהליך האנגיוגנזה, כך שההשפעה ירודה.
הזדקנות תאים, הזדקנות ו- PRP
ניתן לגרום להכנסת תאים על ידי גירויים שונים.זהו תהליך בו התאים מפסיקים לחלק ועוברים שינויים פנוטיפיים ייחודיים כדי למנוע צמיחה בלתי מוגבלת של תאים פגומים, הממלאים תפקיד חשוב במניעת סרטן.בתהליך ההזדקנות הפיזיולוגית, הזדקנות שכפול התאים תקדם גם את הזדקנות התאים, ויכולת ההתחדשות של MSCs תקטן.
השפעות של הזדקנות והזדקנות תאים
In vivo, סוגי תאים רבים יתיישנו ויצטברו ברקמות שונות במהלך הזדקנות, ביניהן מספר גדול של תאים מזדקנים.נראה כי הצטברות תאי הזדקנות גוברת עם עליית הגיל, נזק למערכת החיסון, נזק לרקמות או גורמים הקשורים ללחץ.המנגנון של הזדקנות סלולרית זוהה כגורם הפתוגני של מחלות הקשורות לגיל, כמו דלקת מפרקים ניוונית, אוסטאופורוזיס וניוון דיסקים בין-חולייתי.מגוון גירויים יחמירו את הזדקנות התאים.בתגובה, הפנוטיפ המפריש הקשור להזדקנות (SASP) יפריש ריכוזים גבוהים של תאי חלבון וציטוקינים.פנוטיפ מיוחד זה קשור לתאים מזדקנים, בהם הם מפרישים רמות גבוהות של ציטוקינים דלקתיים (כמו IL-1, IL-6, IL-8), גורמי גדילה (כמו TGF- β 、 HGF, VEGF, PDGF), MMP, וקתפסין.בהשוואה לצעירים, הוכח כי SAPS גדל עם הגיל, מכיוון שתהליך המצב היציב נהרס, וכתוצאה מכך הזדקנות תאים ויכולת התחדשות מופחתת.באופן ספציפי, במחלות מפרקים ובמחלות שרירים שלד.בהקשר זה, הזדקנות החיסון נחשבת לשינוי משמעותי בספקטרום ההפרשה של תאי חיסון, מה שמצביע על כך שהריכוז של TNF-A, IL-6 ו/או IL-1B עולה, מה שמוביל לדלקת כרונית בדרגה נמוכה.ראוי לציין כי תפקוד לקוי של תאי גזע קשור גם למנגנונים אוטונומיים שאינם תאיים, כמו תאים מזדקנים, במיוחד ייצור גורמים פרו-דלקתיים ואנטי-נידוניים באמצעות SASP.
נהפוך הוא, SASP יכולה גם לעורר פלסטיות תאים ותכנות מחדש של תאים סמוכים.בנוסף, SASP יכולה לארגן את התקשורת עם מתווכים חיסוניים שונים ולהפעיל תאי חיסון כדי לקדם את אישור התאים המזדקנים.הבנת התפקיד ותפקודם של תאי הזדקנות תתרום לריפוי ושיפוץ רקמות של שרירי MSK ופצעים כרוניים.
ראוי לציין כי Ritcka et al.בוצע מחקר נרחב, והתגלה התפקיד העיקרי והמועיל של SASP בקידום פלסטיות תאים והתחדשות רקמות, והתגלה הרעיון של אספקת טיפול חולף של תאים מזדקנים.הם ציינו בזהירות כי הזדקנות היא בעיקר תהליך מועיל ומחודש.
הזדקנות תאים ופוטנציאל של PRP
ככל שמספר תאי הגזע יורד, ההזדקנות תשפיע על ביצועי תאי הגזע.באופן דומה, אצל בני אדם, מאפייני תאי הגזע (כמו יובש, התפשטות ובידול) יורדים גם הם עם הגיל.וואנג ונירמלה דיווחו כי ההזדקנות תפחית את המאפיינים של תאי גזע של תאי הגיד ומספר קולטני גורם הגדילה.מחקר בבעלי חיים הראה כי ריכוז ה- PDGF אצל סוסים צעירים היה גבוה.הם הגיעו למסקנה כי העלייה במספר קולטני ה- GF ומספר ה- GF אצל אנשים צעירים עשויה להיות בתגובה סלולרית טובה יותר לטיפול ב- PRP בהשוואה לאנשים מבוגרים בקרב אנשים צעירים.ממצאים אלה חושפים מדוע טיפול ב- PRP עשוי להיות פחות יעיל או אפילו לא יעיל בקרב חולים קשישים עם פחות תאי גזע ו"איכות ירודה ".הוכח כי תהליך ההזדקנות של סחוס מזדקן מתהפך ותקופת המנוחה של כונדרוציטים מוגברת לאחר הזרקת PRP.JIA et al.הוא משמש לחקר פיברובלסטים עוריים של עכברים בצילומים חוץ גופיים, עם וללא טיפול ב- PRP, כדי להבהיר את המנגנון של פעולת נגד PGF במודל זה.קבוצת PRP הראתה השפעה ישירה על המטריצה החוץ תאית, הגברת קולגן מסוג I והפחתה בסינתזה של מטלופרוטאינזים, מה שמצביע על כך ש- PRP יכול לנטרל הזדקנות תאים, וגם במחלת MSK ניוונית.
במחקר אחר, PRP שימש לאיסוף תאי גזע מח עצם בגילאים מעכברים בגילאים.נקבע כי PRP יכול לשחזר מגוון של תפקודי תאי גזע מהזדקנות, כמו התפשטות תאים ויצירת מושבה, ולשחזר את הסמנים הקשורים להזדקנות תאים.
לאחרונה, אוברלוהר ועמיתיו בדקו בהרחבה את תפקיד הזדקנות התאים בהחלשת התחדשות השרירים, והעריכו פלזמה PRP ופלזמה ענית טסיות דם (PPP) כאפשרויות טיפול ביולוגיות לתיקון שרירי השלד.הם רואים כי טיפול ב- PRP או PPP לתיקון שרירי השלד יתבסס על גורמים ביולוגיים המותאמים אישית עבור סמני תאים ספציפיים של SASP וגורמים אחרים המובילים להתפתחות פיברוזיס.
סביר להאמין שלפני יישום PRP, הזדקנות תאים ממוקדת יכולה לשפר את מאפייני ההתחדשות של יעילות הטיפול הביולוגי על ידי הפחתת גורמי SASP מקומיים.הוצע כי אפשרות נוספת לשיפור תוצאות הטיפול ב- PRP ו- PPP להתחדשות שרירי השלד היא הסרת סלקטיבית תאים מזדקנים עם נבלות מזדקנות.אין ספק שתוצאות המחקר האחרונות על השפעת PRP על הזדקנות תאים והזדקנות מרתקות, אך הן עדיין נמצאות בשלב הראשוני.לכן, אין זה הגיוני להציע כל הצעה בשלב זה.
(התוכן של מאמר זה מודפס מחדש, ואיננו מספקים כל ערבות מפורשת או משתמעת לדיוק, מהימנות או שלמות התוכן הכלול במאמר זה, ואיננו אחראים לדעות של מאמר זה, אנא הבינו.)
זמן פרסום: מרץ-01-2023